作者: 发布时间:2020-02-27 来源:复旦发展研究院+收藏本文
过去一年,基因测序、基因编辑技术、和疾病的基因疗法发展迅速。美国《科学》杂志在2020年1月2日刊登的文章中,预测了2020生物技术领域可能出现的重大事件,包括中美不同团队分别进行的多项使用“基因剪刀”技术CRISPR治疗癌症等疾病的临床试验可能发布结果,运用CRISPR技术进行异种器官移植的人体也临床试验有望在2020年启动,解决移植肝脏、心脏、角膜等器官或组织的短缺难题。基因治疗已经成为生物医学发展上的重要阵地。
2019年11月7日,美国广播公司(ABC news)报道,美国首次尝试使用一种被称为CRISPR的基因编辑工具在人类癌症患者身上进行临床试验的结果“让人受到鼓舞”。这项临床试验在2019年三月份就a已受到不少关注,到11月6日,据报告显示,两位患者一位病情在持续恶化,而另一位则趋于稳定。虽然第三位患者接受基因编辑治疗的时间尚短难以做出判断,但研究者表示已经“颇受鼓舞”。
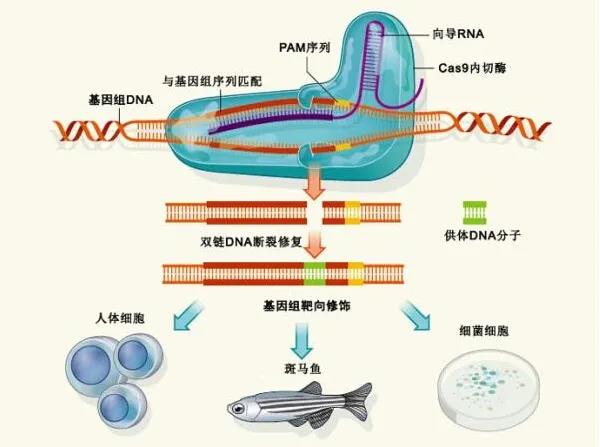
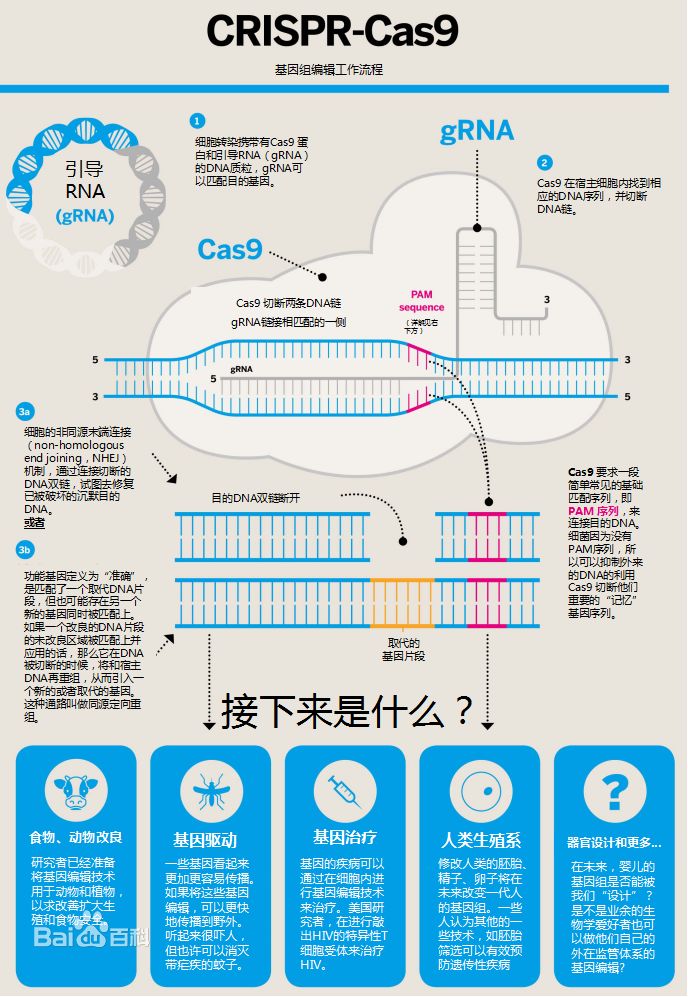
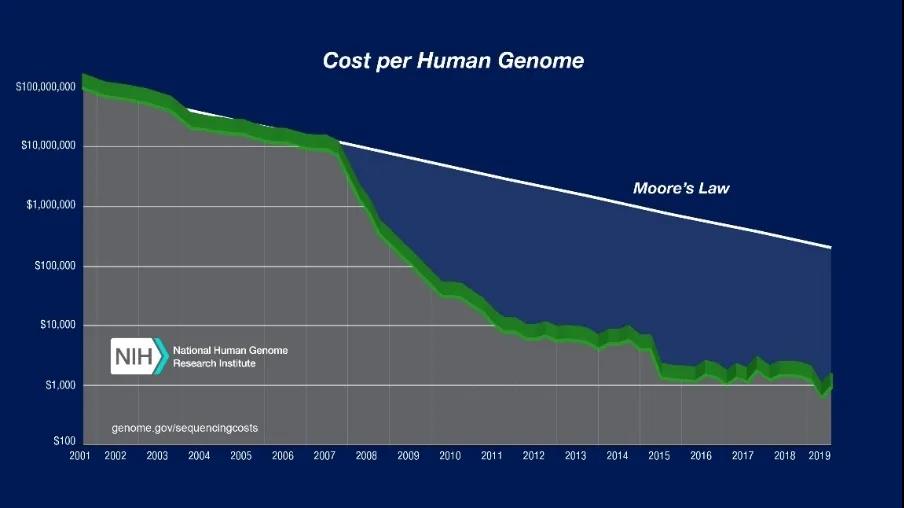
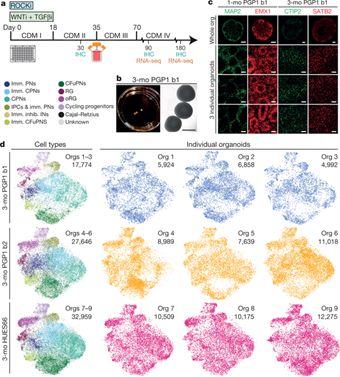
利用基因编辑实现疾病治疗与控制,改善人类生存与健康

1.ABC News. (2019).Doctors try CRISPR gene editing for cancer, a first in the US. [online] Available at: https://6abc.com/health/doctors-try-crispr-gene-editing-for-cancer-a-first-in-the-us/5676166/ [Accessed 2 Jan. 2020].
2.Basudeb Maji, Soumyashree A. et al. A High-Throughput Platform to Identify Small-Molecule Inhibitors of CRISPR-Cas9. Cell, 2019; 177 (4): 1067 DOI: 10.1016/j.cell.2019.04.009
3.Cassidy, Justin J, et al. (2019) Repressive gene regulation synchronizes development with cellular metabolism. Cell, 178 (4). pp. 980-992. ISSN 0092-8674.
4. Cell Press (2019). Drugs that block CRISPR-Cas9 genome editing identified. [online] ScienceDaily. Available at: https://www.sciencedaily.com/releases/2019/05/190502111043.htm [Accessed 30 Dec. 2020].
5.Cohen, J., Desai, N. (2019).With its CRISPR revolution, China becomes a world leader in genome editing. [online] Science | AAAS. Available at: https://www.sciencemag.org/news/2019/08/its-crispr-revolution-china-becomes-world-leader-genome-editing [Accessed 8 Jan. 2020].
6.Cross-Disorder Group of the Psychiatric Genomics Consortium,Genomic Relationships, Novel Loci, and Pleiotropic Mechanisms across Eight Psychiatric Disorders, Cell, Volume 179, Issue 7, 2019, Pages 1469-1482.e11, ISSN 0092-8674,https://doi.org/10.1016/j.cell.2019.11.020.
7.Escobar, Thelma & Oksuz, Ozgur & Descostes, Nicolas & Bonasio, Roberto & Reinberg, Daniel. (2019).Active and Repressed Chromatin Domains Exhibit Distinct Nucleosome Segregation During DNA Replication. SSRN Electronic Journal. 10.2139/ssrn.3323374.
8.Fadi Jacob et al.A Patient-Derived Glioblastoma Organoid Model and Biobank Recapitulates Inter- and Intra-tumoral Heterogeneity. Cell, 2019, doi:10.1016/j.cell.2019.11.036.
9.Gorka Lasso, Sandra V. Mayer, Evandro R. Winkelmann, et al.A Structure-Informed Atlas of Human-Virus Interactions[J].Cell. August 29, 2019. DOI:https://doi.org/10.1016/j.cell.2019.08.005.
10.Grünewald, J., Zhou, R., Garcia, S., Iyer, S., Lareau, C., Aryee, M. and Joung, J. (2019). Transcriptome-wide off-target RNA editing induced by CRISPR-guided DNA base editors.Nature, 569(7756), pp.433-437.
11.Hagan, T., Cortese, M., Rouphael, N., Boudreau, C., Linde, C., Maddur, M., Das, J., Wang, H., Guthmiller, J., Zheng, N., Huang, M., Uphadhyay, A., Gardinassi, L., Petitdemange, C., McCullough, M., Johnson, S., Gill, K., Cervasi, B., Zou, J., Bretin, A., Hahn, M., Gewirtz, A., Bosinger, S., Wilson, P., Li, S., Alter, G., Khurana, S., Golding, H. and Pulendran, B. (2019).Antibiotics-Driven Gut Microbiome Perturbation Alters Immunity to Vaccines in Humans. Cell, 178(6), pp.1313-1328.e13.
12.Han, D., Liu, J., Chen, C. et al. Anti-tumour immunity controlled through mRNA m6A methylation and YTHDF1 in dendritic cells. Nature 566, 270–274 (2019) doi:10.1038/s41586-019-0916-x
13.Harald Hartweger et al.HIV-specific humoral immune responses by CRISPR/Cas9-edited B cells, The Journal of Experimental Medicine (2019). DOI: 10.1084/jem.20190287.
14.Heckmann, B., Teubner, B., Tummers, B., Boada-Romero, E., Harris, L., Yang, M., Guy, C., Zakharenko, S. and Green, D. (2019).LC3-Associated Endocytosis Facilitatesβ-Amyloid Clearance and Mitigates Neurodegeneration in Murine Alzheimer’s Disease. Cell, 178(3), pp.536-551.e14.
15.Idrus, A. (2020).New enzyme boosts 'CRISPR toolbox' for disease detection. [online] FierceBiotech. Available at: https://www.fiercebiotech.com/research/new-enzyme-boosts-crispr-toolbox-for-disease-detection [Accessed 22 Dec. 2019].
16.Jin,S. et al., (2019) Cytosine, but not adenine, base editors induce genome-wideoff-target mutations in rice. Science, DOI:10.1126/science.aaw7166
17.Jun-Jie Liu, Natalia Orlova, Benjamin L. Oakes, et al.CasX enzymes comprise a distinct family of RNA-guided genome editors, Nature (2019). DOI: 10.1038/s41586-019-0908-x
18.Kim, S., Kwon, S., Kam, T., Panicker, N., Karuppagounder, S., Lee, S., Lee, J., Kim, W., Kook, M., Foss, C., Shen, C., Lee, H., Kulkarni, S., Pasricha, P., Lee, G., Pomper, M., Dawson, V., Dawson, T. and Ko, H. (2019). Transneuronal Propagation of Pathologicα-Synuclein from the Gut to the Brain Models Parkinson’s Disease.Neuron, 103(4), pp.627-641.e7Liu, X., Wang, Y., Lu, H. et al. Genome-wide analysisidentifies NR4A1 as a key mediator of T cell dysfunction. Nature 567, 525–529 (2019) doi:10.1038/s41586-019-0979-8
19.Liu, A. (2019).CRISPR edits out a deadly lung disease in mice before birth. [online] FierceBiotech. Available at: https://www.fiercebiotech.com/research/crispr-editing-out-a-deadly-lung-disease-before-birth [Accessed 22 Dec. 2020].
20.Pan, Y., Yang, J., Luan, X., Liu, X., Li, X., Yang, J., Huang, T., Sun, L., Wang, Y., Lin, Y. and Song, Y. (2019). Near-infrared upconversion–activated CRISPR-Cas9 system: A remote-controlled gene editing platform.Science Advances, 5(4), p.eaav7199.
21.Prosser, M. (2019).Inside China's Play to Become the World’s CRISPR Superpower. [online] Singularity Hub. Available at: https://singularityhub.com/2019/08/18/inside-chinas-play-to-become-the-worlds-crispr-superpower/ [Accessed 2 Jan. 2020].
22.Sangjune Kim, Seung-Hwan Kwon, et al.Transneuronal Propagation of Pathologicα-Synuclein from the Gut to the Brain Models Parkinson’s Disease[J]. Neuron, 2019; DOI: 10.1016/j.neuron.2019.05.035
23.Silva, D., Yu, S., Ulge, U.Y. et al. De novo design of potent and selective mimics of IL-2 and IL-15. Nature 565, 186–191 (2019) doi:10.1038/s41586-018-0830-7
24.Tian, X., Gu, T., Patel, S., Bode, A., Lee, M. and Dong, Z. (2019). CRISPR/Cas9–An evolving biological tool kit for cancer biology and oncology.npj Precision Oncology, 3(1).
25.Velasco, S., Kedaigle, A., Simmons, S., Nash, A., Rocha, M., Quadrato, G., Paulsen, B., Nguyen, L., Adiconis, X., Regev, A., Levin, J. and Arlotta, P. (2019). Individual brain organoids reproducibly form cell diversity of the human cerebral cortex.Nature, 570(7762), pp.523-527.
26.Wetterstrand, K. (2019).DNA Sequencing Costs: Data from the NHGRI Genome Sequencing Program (GSP). [online] Genome.gov. Available at: https://www.genome.gov/about-genomics/fact-sheets/DNA-Sequencing-Costs-Data [Accessed 3 Jan. 2020].
27.Matthew B. Dong, et al.Systematic Immunotherapy Target Discovery Using Genome-Scale In Vivo CRISPR Screens in CD8 T Cells, Cell (2019). DOI:10.1016/j.cell.2019.07.044
28.Nurnberg.com.cn. (2014).胡安•恩里克斯和斯蒂文•迦兰斯. [online] Available at: http://www.nurnberg.com.cn/author/author_show.aspx?id=4511&author_id=0 https://www.ted.com/talks/juan_enriquez_the_age_of_genetic_wonder_nov_2019/transcript?language=zh-cn [Accessed 30 Dec. 2020].Velasco, S., Kedaigle, A.J., Simmons, S.K. et al. Individual brain organoids reproducibly form cell diversity of the human cerebral cortex. Nature 570, 523–527 (2019) doi:10.1038/s41586-019-1289-x
29.Paper.people.com.cn. (2020).《科学》杂志展望2020年十大科学头条. [online] Available at: http://paper.people.com.cn/rmrb/html/2020-01/04/nw.D110000renmrb_20200104_10-03.htm [Accessed 2 Jan. 2020].
30.Prosser, M. (2020).Inside China's Play to Become the World’s CRISPR Superpower. [online] Singularity Hub. Available at: https://singularityhub.com/2019/08/18/inside-chinas-play-to-become-the-worlds-crispr-superpower/ [Accessed 31 Dec. 2020].
31.Tian, X., Gu, T., Patel, S., Bode, A., Lee, M. and Dong, Z. (2019). CRISPR/Cas9–An evolving biological tool kit for cancer biology and oncology.npj Precision Oncology, 3(1).
32.Zhou, C., Sun, Y., Yan, R. et al. Off-target RNA mutation induced by DNA base editing and its elimination by mutagenesis. Nature 571, 275–278 (2019) doi:10.1038/s41586-019-1314-0
33. 基因谷(2018).基因周报—2020年前全基因组测序价降至三百美元以内. [online] Sohu.com. Available at: http://www.sohu.com/a/216606696_733985 [Accessed 3 Jan. 2020].